Evaluación
de parámetros seminales y factores de riesgo asociados a infertilidad en
hombres, Provincia de Misiones, Argentina, 2019-2022
Evaluation of seminal parameters and risk
factors associated with infertility in men, Misiones province, 2019-2022
Ares Rocío1, Aguirre Cristina2, Nechesny Kiszko
Gabriela1, Alvarenga Marina1, Benítez Tania1,
Blanco Melisa2, Fernández Anyelén1, Jara, Daniela1,
Krentz Mikaela1, *Bonneau Graciela1
1 Residencia de Bioquímica Clínica. Ministerio de Salud Pública de la
Provincia de Misiones. Argentina.
2 Laboratorio de Alta Complejidad
Misiones. Argentina.
Correspondencia: grabonneau@gmail.com
Conflicto de intereses: las personas autoras declaran no tener conflictos de
intereses.
RESUMEN
INTRODUCCIÓN:
El espermograma es un examen bioquímico esencial principalmente en la
evaluación de la infertilidad. Incluye la evaluación de las características
macroscópicas y microscópicas del semen. Múltiples factores producen su
alteración (endócrinos, genéticos, urológicos, infecciosos, envejecimiento,
exposición a sustancias, hábitos tóxicos). OBJETIVO: analizar los parámetros
seminales y su relación con factores de riesgo de infertilidad en hombres que
acudieron a un centro de Salud Pública de Misiones entre 2019 y 2022. MATERIALES
y MÉTODOS: estudio descriptivo transversal de revisión de resultados de
laboratorio e historias clínicas. Fueron incluidos 334 pacientes con una
mediana de 34 años de edad. RESULTADOS: El 89% presentó alguna alteración en
sus parámetros de los cuales 50% presentó licuefacción parcial, 42,8%
hiperviscosidad, 29,3% astenozoospermia y 28% vitalidad espermática disminuida.
Se halló prevalencia de oligospermia y azoospermia del 24% y 3%,
respectivamente. El 27% presentó teratozoospermia (alteraciones de la pieza
intermedia las más frecuentes) y 38% leucospermia. Los factores de riesgo (FR)
de infertilidad más frecuentes fueron los hábitos tóxicos, varicocele e
infecciones genitourinarias. Se observó una elevada frecuencia de alteraciones
espermáticas en presencia de estos, donde varicocele se asoció estadísticamente
a la astenozoospermia. DISCUSIÓN: La importancia de este estudio radica en la
caracterización regional tanto de los parámetros mayormente alterados del
espermograma como de FR asociados a infertilidad masculina en pos de trabajar
en forma interdisciplinaria para que el paciente pueda realizar el tratamiento
de fertilidad pertinente, el seguimiento de una patología o el análisis de su
capacidad reproductiva.
Palabras
clave: Infertilidad Masculina; Parámetros Seminales; Espermograma.
ABSTRACT
INTRODUCTION:
The semen analysis (spermiogram) is an essential biochemical test, primarily
used in the evaluation of infertility. It includes the assessment of both
macroscopic and microscopic characteristics of semen. Multiple factors can
cause alterations in these parameters (endocrine, genetic, urological,
infectious, aging, exposure to substances, toxic habits). OBJECTIVE: To evaluate semen
parameters and their association with infertility risk factors in men attending
a public health center in Misiones province between 2019 and 2022.
MATERIALS AND METHODS:
A cross-sectional descriptive study based on a review of laboratory results and
medical records. A total of 334 patients were included, with a median age of 34
years. RESULTS: 89%
presented some alteration in their semen parameters, of which 50% had partial
liquefaction, 42.8% hyperviscosity, 29.3% asthenozoospermia, and 28% reduced
sperm vitality. The prevalence of oligospermia and azoospermia was found to be
24% and 3%, respectively. 27% presented teratozoospermia (with midpiece
abnormalities being the most frequent), and 38% had leukospermia. The most
frequent infertility risk factors (RF) were toxic habits, varicocele, and
genitourinary infections. A high frequency of sperm abnormalities was observed
in the presence of these factors, with varicocele being statistically
associated with asthenozoospermia. DISCUSSION:
The importance of this study lies in the regional characterization of both the
most frequently altered semen parameters and the risk factors associated with
male infertility. This aims to encourage interdisciplinary work so that
patients can undergo appropriate fertility treatments, follow-up of underlying
conditions, or assessment of their reproductive capacity.
Key words: Male Infertility; Seminal Parameters; Spermiogram
INTRODUCCIÓN
El espermograma es
el examen bioquímico de diagnóstico más importante y sencillo para iniciar el
estudio de la fertilidad masculina, como así también para el estudio de
enfermedades genitales masculinas y de patologías como las provocadas por la
exposición a productos químicos, factores ambientales, agentes infecciosos y
medicamentos, entre otras1. Además, permite evaluar qué tipo de
tratamiento médico o quirúrgico se debe llevar a cabo en caso de infertilidad,
brinda una primera impresión diagnóstica y permite el seguimiento de los
tratamientos ya efectuados2-5.
Para que un espermograma pueda ser interpretado correctamente
es necesario suministrar al paciente información clara y completa de la forma
como se debe tomar la muestra seminal. También es fundamental que la muestra
sea analizada por un laboratorio que garantice el correcto procesamiento6.
En la determinación de los parámetros seminales existe un
grado de error analítico donde el espermograma pierde por completo
su utilidad clínica si no se realiza bajo estrictas normas de control. En
respuesta a la gran necesidad de estandarizar o sistematizar los procedimientos
asociados al análisis seminal la Organización Mundial
de la Salud (OMS)7,8 ha publicado sucesivas ediciones del Manual
de laboratorio de la OMS para el Examen y Procesamiento de Semen Humano, que
sirven de guía para los laboratorios que realizan este tipo de análisis
bioquímico.
El examen del semen consiste en su evaluación macroscópica y
microscópica de las características físicas como el aspecto, volumen, pH,
licuefacción, viscosidad y color, y de las características celulares que
estudia al espermatozoide en relación a número, movilidad, morfología y
vitalidad. También ofrece información valiosa sobre la presencia de otras
células como leucocitos, bacterias, hongos, y células de la progenie
espermática. El líquido seminal que es producido por las glándulas sexuales anexas
puede ser evaluado además desde el punto de vista bioquímico e inmunológico5.
Se han
identificado múltiples factores que producen alteraciones observables a nivel
del espermograma, como algunas patologías endócrinas, genéticas, urológicas,
infecciosas, como así también el envejecimiento y la exposición
a ciertas sustancias tóxicas, ya sea por hábitos como tabaquismo o consumo de
drogas, o a factores ambientales como plaguicidas, radiaciones o metales
pesados, entre otros6, 9-12.
En un estudio
realizado en la provincia argentina de Córdoba durante 10 años (1995-2004)
sobre 9168 hombres de entre 20 y 77 años de edad con problemas de fertilidad se
halló un descenso significativo en el volumen seminal, el recuento espermático,
la motilidad, la vitalidad y el porcentaje de espermatozoides morfológicamente
normales en relación con la edad13. También en la misma provincia,
durante 2013-2015, se evaluaron las características seminales y se halló que el
63% tenía espermogramas anormales. Las alteraciones más frecuentemente
encontradas fueron: teratozoospermia (72%), leucospermia (46%), hipospermia (30%)
y, a diferencia de lo reportado en la bibliografía, las alteraciones en la
calidad seminal según grupo etario fueron similares14.
Otro estudio
realizado en 2010 investigó la frecuencia de alteraciones en el espermograma de
una cohorte europea en estudio por infertilidad (n=4457). El 24,6% presentaba
menos de 39x106 espermatozoides y 9,8% azoospermia. En cuanto a la
motilidad, 1447 individuos (36%) presentaron menos de 32% de motilidad
progresiva, inmóviles 0,6% (24). El 56% (2251) presentó teratozoospermia y el
5% (201) ningún espermatozoide morfológicamente normal15.
El presente
trabajo tuvo como objetivo analizar los parámetros seminales y su relación con
factores de riesgo de infertilidad en hombres que acudieron a un centro de
Salud Pública de Misiones entre 2019 y 2022.
MATERIALES Y
MÉTODOS
Se realizó un estudio descriptivo transversal
utilizando un muestreo no probabilístico por conveniencia. En cuanto a la
población estudiada los criterios de inclusión fueron hombres mayores a 18 años
que concurrieron por primera vez a realizarse un espermograma al Laboratorio de
Alta Complejidad de Misiones (LACMI) entre enero de 2019 y mayo de 2022. Se
excluyeron a aquellos que presentaron informes o historias clínicas incompletas
e individuos que presentaron una vasectomía al momento del estudio.
El acceso a los
informes de laboratorio de los individuos participantes del estudio se realizó
a través del Sistema Informatizado de Laboratorio (LIS) NextLABⓇ
mediante
el cual se seleccionaron todos los espermogramas que cumplieron con los
criterios de selección. La revisión de las historias clínicas de estos
pacientes se realizó a través del sistema informático RISMI (Red de Información
de Salud de Misiones).
Parámetros
bioquímicos
La toma de muestra
de los espermogramas incluidos en el estudio se realizó en el LACMI siguiendo
las recomendaciones de la OMS7,8. Cada paciente recibió las
indicaciones para la toma de muestra en forma oral y escrita, a saber:
concurrir al laboratorio con 3 a 5 días de abstinencia sexual, obtener la
muestra por masturbación (sin geles, preservativos, ni coito interrupto),
colocar toda la muestra dentro del frasco estéril y entregar antes de los 30
minutos de obtención, a temperatura corporal.
El procesamiento
de los espermogramas se realizó en forma manual siguiendo las recomendaciones
de la OMS7,8.
Definición operacional de las variables y categorías.
A
través de la RISMI se tomaron datos sociodemográficos (edad, localidad de
procedencia, motivo de consulta, ocupación laboral) a partir de la historia
clínica electrónica de los pacientes. De la red también se recolectaron los factores
de riesgo (FR) para infertilidad, considerándose como tales a las afecciones
testiculares (varicocele, orquitis, quistes, traumas, dolor referido,
hipotrofia, agenesia, hidrocele), infecciones del tracto genitourinario,
antecedentes de parotiditis y COVID-19, hábitos tóxicos (tabaquismo,
alcoholismo, drogas ilícitas), exposición a contaminantes
o tóxicos (plaguicidas, organofosforados, carbamatos, piretrinas y
organoclorados), consumo o medicación (testosterona, esteroides
anabólicos, ketoconazol, quimioterapia, antidepresivos inhibidores selectivos
de la recaptación de serotonina y alfa bloqueantes).
Del
LIS NextLABⓇ se recolectaron los parámetros
seminales: características fisicoquímicas (volumen, color, aspecto, viscosidad,
licuefacción) y características microscópicas (movilidad, vitalidad,
concentración espermática, número de espermatozoides por eyaculado, porcentaje
de espermatozoides normales, alteraciones morfológicas, concentración de
leucocitos, presencia de células acompañantes). Los valores de referencia
fueron considerados siguiendo las indicaciones de la quinta edición del Manual
para la examinación y procesamiento del semen humano de la OMS7.
Análisis
estadístico
Se evaluó la distribución de los datos cuantitativos con el test de
normalidad de Kolmogorov-Smirnov. De acuerdo a ello, para el análisis
descriptivo de las variables paramétricas se utilizó las medias y los desvíos
estándares (DS); para las variables no paramétricas se utilizó medianas y
percentiles 25 y 75. Las variables cualitativas se describieron con porcentajes
y sus correspondientes intervalos de confianza (IC). Para comparación entre
grupos se utilizó la prueba de Chi cuadrado para variables cualitativas.
Todos los análisis estadísticos se realizaron utilizando el programa SPSS, con
un nivel de significación p<0,05.
El
estudio fue aprobado por el Comité de Ética de la
Investigación Central de la provincia de Misiones el cual determinó que por las
características del estudio no era necesario la aplicación del consentimiento
informado. Asimismo fue autorizado por las autoridades institucionales correspondientes
y por los departamentos y comisiones de docencia e investigación.
RESULTADOS
Se
revisaron 398 informes de espermogramas, de los cuales fueron excluidos 64, de
estos 54 correspondían a repeticiones del mismo paciente (47 segundas muestras,
5 terceras, 1 cuarta y 1 quinta) y 10 eran controles post vasectomía. Por lo
tanto fueron incluidos 334 pacientes cuya mediana de edad fue de 34 años (p25-
p75=27-38).
El
lugar de residencia más frecuente de los pacientes fue Posadas (capital de la
provincia de Misiones) con 66,8 % (IC95%=61,4-71,8; n=223), seguido por otras
localidades del interior de la provincia 31,1% (IC95%=26,3-36,5; n=104), 4
individuos de la provincia de Corrientes (1,2 %; IC 95%= 0,4 - 3,3) y 3 de la
vecina República de Paraguay (0,9 %; IC 95%= 0,2 - 2,8).
Entre
las ocupaciones más frecuentes registradas entre los pacientes se encontraron
las de albañil/empleados en la construcción con el 3,6% (IC95%= 2,0-6,4; n=12)
y empleados de comercio con 2,4% (IC95%= 1,1-4,9; n=8). Otras de las
ocupaciones halladas fueron panadero, empleado municipal, taxista/remisero,
vendedor, técnico en refrigeración, personal de salud, personal de seguridad,
pensionado, gastronomía/cocinero, estudiante, contador público, empleado en
aserradero, actividad informal, repostero, empleado de cooperativa, agricultor,
técnico, chipero, emprendedor, chofer, docente, servicio penitenciario, fábrica
de alambre, rural, jornalero, gestión de cobros, Dj, fletes y lavandería. El
2,4 % de los pacientes (IC95%= 1,1-4,9; n=8) eran desocupados.
Respecto
a los principales motivos de consulta registrados se hallaron: fertilidad (22,8%)
(IC95% 18,5-27,7; n=76); esterilidad (18%)(IC95% 14,1-22,6; n=60), infertilidad
7,5% (IC95% 5,0-11,0; n=25), varicocele 5,4% (IC95% 3,3-8,5; n=18) y dolor
testicular 2,1%(IC95% 0,9-4,5; n=7).
Parámetros
bioquímicos
En
primer lugar cabe mencionar que del total de pacientes analizados, el 89% (IC
95%: 85,0 - 92,0; n=297) presentó espermogramas alterados, es decir, con al
menos una anormalidad en los parámetros bioquímicos analizados. Las alteraciones obtenidas de la evaluación macroscópica se observan en la Tabla 1.
Al
analizar los parámetros de la evaluación microscópica, se observa que del total
de pacientes analizados, solo 300 contaban con los datos de motilidad y
vitalidad, ya que en los restantes el recuento de espermatozoides fue muy bajo
y por lo tanto no se informaron estos parámetros. En lo que a motilidad se
refiere, el 29,3% [IC 95%: 24,3-34,3; n=88] presentó astenozoospermia en tanto
que el 28% [IC95%: 20,7-30,2; n=84] registraba vitalidad disminuida.
Con
respecto a la concentración espermática, se obtuvo una mediana de 48 millones
de espermatozoides por mililitro (p25=28 - p75=81), y una mediana de 150
millones por eyaculado para espermatozoides totales (p25=72 - p75=270). Cabe
mencionar que 3% [IC 95%: 1,5 - 5,6%; n=10] presentó azoospermia y en 24% [IC
95%: 19,6 - 29,0%; n=80] se observó oligospermia. Al analizar la morfología
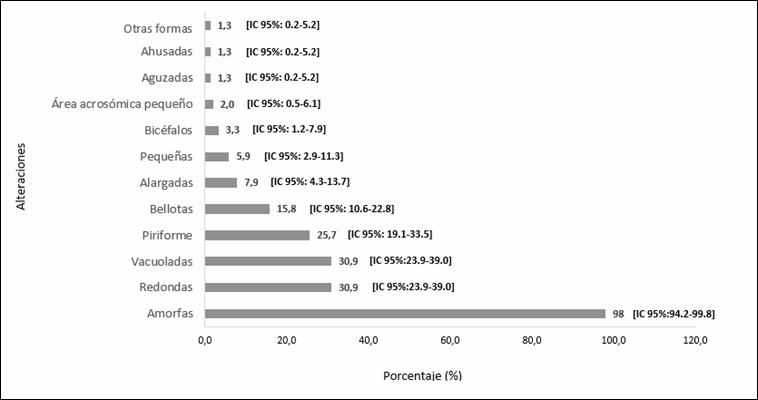
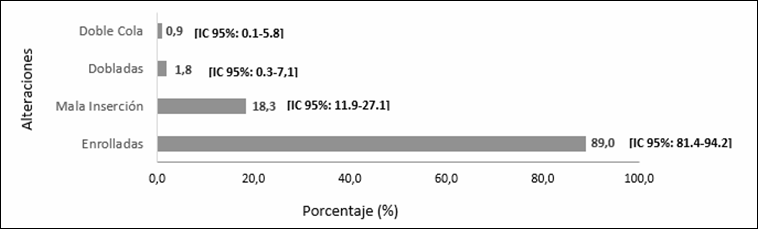
espermática (n=293), se observó que el 27% [IC 95%= 22,1-32,5; n=79] presentó
teratozoospermia. La región espermática de la pieza intermedia se presentaba
alterada en 71% [IC 95%= 65,4-76,1; n=208] de los pacientes, seguida de
alteraciones en la cabeza 52,9% [IC 95%= 47,0-58,7; n=155] y la cola 37,9% [IC
95%= 32,4- 43,7; n=111]. Cabe mencionar que cada paciente puede presentar más de una alteración en las regiones espermáticas
observadas.
Las alteraciones morfológicas de cada región espermática se
observan en los gráficos 1 (alteraciones de la cabeza), 2 (de la parte
intermedia) y 3 (de la cola). Además se presentaron alteraciones en la cabeza
espermática: alfiler (n=1) y cónicas (n=1) que no fueron incluidos en el
gráfico 2, ya que presentaban una frecuencia menor al 1%.
Con
respecto a la presencia de células, se obtuvo que el 38 % de los pacientes
incluidos presentó leucospermia [IC 95%= 32,9- 43,5; n=127]; 2% [IC 95%= 0,9 -
4,5; n=7] presentó células de la progenie espermática y en 0,6% [IC 95%= 0,1 –
2,4; n=2] se registró agregación espermática inespecífica.
Factores
de riesgo asociados a infertilidad
Solamente
112 pacientes presentaron datos sobre FR de infertilidad en sus historias
clínicas. Estos se agruparon en hábitos tóxicos
(44,4%), afecciones testiculares (21,3%), infecciones del tracto genitourinario (5%) y obstrucciones
anatómicas (4,6%) (Ver Tabla 2). Además, cabe mencionar que solamente 12
pacientes presentaron espermogramas normales.
Se
registraron otras causas posibles de infertilidad como antecedentes de
traumatismos (13), hipertensión arterial (7), obesidad (8) y diabetes (4). Se
consignaron casos de consumo de medicamentos, entre ellos psicofármacos como
alprazolam, carbamazepina y quetiapina, uso de corticoides, fármacos citostáticos
y antihipertensivos. No se hallaron datos respecto de la exposición a
contaminantes, antecedentes de parotiditis, ni COVID-19.
Relación
entre FR asociados a infertilidad y alteraciones de los parámetros espermáticos
Si
bien las frecuencias de FR obtenidas en el presente trabajo no son suficientes
para establecer asociaciones estadísticas concluyentes, en la Tabla 3 se
presentan las frecuencias y porcentajes de cada alteración espermática en los grupos
de FR que fueron más prevalentes. No hubo relación estadísticamente
significativa entre dichos FR y las alteraciones espermáticas analizadas,
excepto entre las variables varicocele y astenozoospermia.
DISCUSIÓN
En el
presente estudio que incluyó a 334 pacientes de distintos puntos de la
provincia de Misiones, el principal motivo de consulta fue fertilidad, seguido
de esterilidad e infertilidad; y si bien no es habitual diferenciar ambos
términos, esterilidad e infertilidad tienen distintas definiciones, ya que la
primera se refiere a la incapacidad para concebir y la segunda se
refiere a la imposibilidad para finalizar la gestación con el nacimiento de un
niño sano16.
La
mayor parte de los individuos registraba trabajos informales, la principal
ocupación fue albañil/construcción y comerciante. El dato de ocupación laboral
resulta de importancia en la anamnesis del paciente, ya que exposiciones
ambientales a ciertos agentes del entorno (radiaciones, anestésicos,
disolventes orgánicos, monómeros plásticos, metales pesados –
mercurio,
plomo, cadmio) pueden afectar la fertilidad y verse reflejados en el análisis
espermático17. Asimismo es un factor de riesgo laboral la exposición
a temperaturas elevadas, ya que altera el
desarrollo sincrónico de la espermatogénesis y es disparador de eventos
apoptóticos en las células del epitelio germinal. Además desestabiliza y altera
el ADN espermático afectando la capacidad reproductiva masculina10.
Si bien un alto porcentaje de paciente (89%) presentaba al
menos una alteración en los parámetros espermáticos, esto no necesariamente se
traduce en la imposibilidad de concebir y llevar a término un embarazo sino que
se refiere a una disminución en la probabilidad de ello, que podría incluso ser
compensada por la capacidad de concebir de su pareja.
Las
principales alteraciones fueron las macroscópicas entre las que predominó licuefacción
parcial (53%), ligeramente menor a lo hallado en otro estudio en el que
evaluaron los resultados de 292 espermogramas y se halló una licuefacción parcial
o anormal en el 68,49% del total de pacientes18.
En
orden de frecuencia continuó la hiperviscosidad en un 42,8%, mientras que el 8,1%
presentó hipospermia; obteniéndose mayor porcentaje de viscosidad aumentada al
comparar con un estudio realizado en 100 pacientes donde se obtuvo que el 31%
de los mismos presentaba viscosidad aumentada, este mismo estudio reporta un 18%
de volumen anormal, incluyendo en estos volúmenes menores a 2 mL (hipospermia)
y mayores a 5 mL (hiperespermia), sin discriminar los porcentajes
correspondientes a cada uno. Cabe recordar que
el hecho de que un hombre tenga hipospermia no significa necesariamente que
exista un problema de fertilidad, ya que puede perfectamente presentar un semen
con espermatozoides con morfología y movilidad adecuadas así como una
cantidad suficiente19,20. La mayoría de los espermogramas (98,5%)
presentó un pH normal, encontrándose un porcentaje mayor de normalidad
comparándolo con un trabajo donde evaluaron 226 espermogramas y en que se halló
pH con valores normales en el 70,3% de los casos21.
En cuanto a la
concentración espermática, se observó que 10 pacientes (3%) presentaron
azoospermia y que 80 pacientes (24%) presentaron oligospermia. Al comparar
estos resultados con los obtenidos en 2010 por Tournaye, Krausz y Oates, quienes
estudiaron la frecuencia de alteraciones en el espermograma de una cohorte de
hombres europeos en estudio por infertilidad (n=4457) y obtuvieron un 24,6% de
oligospermia y 9,8% azoospermia, podemos observar la similitud en los
porcentajes de oligospermia, mientras que los valores de azoospermia obtenidos
en el presente trabajo son menores; si bien hay que tener en cuenta el n
considerablemente mayor en el estudio europeo y el hecho de que sólo incluyeron
pacientes que consultaron por infertilidad15.
En
el estudio de motilidad y vitalidad de los espermatozoides solo se evaluaron
300 pacientes, los restantes no contaban con datos informados debido al bajo
recuento espermático, ya que cuanto menor es el número de espermatozoides
contados mayor es el error asociado en la clasificación de los mismos. Se
observó astenozoospermia en 88 de los pacientes (29,3%), mientras que 84 de
ellos presentaron espermatozoides con vitalidad disminuida (28%).
El
porcentaje más alto de infertilidad que se registra hasta la fecha se observa en
hombres que presentan el 70% o más de sus espermatozoides con alteraciones
morfológicas5. Según muestra la literatura, la teratozoospermia
comienza a observarse en la adolescencia, es decir que el varón nunca tiene un
alto porcentaje de formas normales sino que desde el inicio de su
espermatogénesis lo frecuente es tener valores cercanos al 30%5. En el
presente estudio, se contaba con datos morfológicos de 293 pacientes de los
cuales el 27% (n=79) presentó teratozoospermia. Al respecto en otras
investigaciones se informaron resultados similares, como la de Morey León22
con un 27,9% (n=204) y la de Caravajal Rivero9 con un 52,66% (n=150)
de alteraciones espermáticas.
En
cuanto a las alteraciones morfológicas analizadas en este trabajo se obtuvo que
la región más afectada se corresponde a la pieza intermedia con un 71%, siendo
el exceso de citoplasma residual la alteración más frecuente, continuaron las
alteraciones de la cabeza 52,9%, predominando cabezas amorfas; y por último
alteraciones en la cola, en un 37,9%, representadas principalmente por colas
enrolladas. A diferencia de lo informado en un estudio realizado por Pendas y cols.
en 2013 sobre consultas de infertilidad realizadas en el Instituto Nacional de
Endocrinología de La Habana (Cuba), con una cohorte de 140 pacientes entre 2009
y 2010, en las muestras de semen analizadas mediante microscopía electrónica de
barrido se encontró que la cola era la región más afectada23. Otros
estudios informaron que las alteraciones que predominaron fueron a nivel de cola,
con colas pequeñas y enrolladas; pieza media con predominio de pieza media
doblada y, por último, en cabeza: con cabezas grandes, amorfas y elongadas con
algunos cambios en la estructura acrosomal, además de espermatozoides con
cabeza de punta (n=140)23.
En
un estudio realizado en 2016 por Rodríguez Pendás y cols. en el cual se
relacionó la presencia de leucocitos seminales con la infertilidad masculina,
se demostró que la presencia de leucospermia en la población es prevalente y
que esta se asocia a un deterioro significativo de la fertilidad masculina24.
En la presente investigación se obtuvo que el 38% de los pacientes presentó
leucospermia y solo 7 pacientes presentaron células germinales en el
espermograma. Por otro parte, en otros estudios con menor número de pacientes
analizados se obtuvieron resultados similares, como Canepa y cols que
analizaron 62 muestras de semen de pacientes miembros de parejas con
subfertilidad y hallaron 46% de pacientes con leucospermia que asistieron a
Sección de Líquido Seminal del Servicio de Bioquímica14. La
literatura hace referencia a que la presencia de leucocitos en el semen está
íntimamente relacionada con la producción de sustancias oxígeno reactivas y se
asocia negativamente con múltiples parámetros de la función espermática, entre
ellos daño acrosómico, deformaciones espermáticas y empobrecimiento de la
movilidad14.
En cuanto al
estudio de FR de infertilidad, hubo escasa información al respecto en las
historias clínicas analizadas, representando solo el 33% del total de los
pacientes estudiados. Se observó que predominaron los hábitos tóxicos,
varicocele e infecciones genitourinarias. Particularmente, la infertilidad
masculina se ha asociado al envejecimiento y a estilos de vida no saludables,
como el consumo de cigarrillos y/o marihuana, la ingesta de alcohol, el
sedentarismo, la dieta, la obesidad, el estrés psicológico, además de factores
medioambientales como la polución y la exposición al calor25.
Puntualmente en el presente estudio se halló que el 26,7% de los pacientes eran
fumadores, al respecto se estima que hasta un 35 % de hombres en edad
reproductiva son fumadores26 y que los hombres que fuman antes o
durante los intentos de concebir tienen una fertilidad disminuida en
comparación con los no fumadores27.
El 20,5% de los
pacientes de esta investigación registró consumo de alcohol. Al respecto cabe
recordar que la ingesta crónica de alcohol conduce a la aparición de
impotencia, atrofia testicular, disminución de la líbido y de la concentración
espermática28.
En lo que refiere
al uso de drogas ilegales, en el presente estudio se reportó un 6,2%,
destacando la marihuana y la cocaína. La marihuana contiene cannabinoides que
reducen la producción de testosterona desde las células de Leydig, modula la
apoptosis de las células de Sertoli y disminuye tanto la espermatogénesis como
la movilidad espermática, la capacitación espermática y la reacción acrosómica29.
Además, el consumo crónico de marihuana se relaciona también con una disminución
de la morfología espermática en la que se reduce el tamaño del núcleo, se
incrementa la condensación de la cromatina y aumenta la ausencia de acrosoma30.
Otra de las drogas más habitualmente consumida es la cocaína, un estimulante
del sistema nervioso central y del periférico. Su utilización se relaciona con
el aumento de prolactina en suero y tiene efectos adversos en la
espermatogénesis31.
Dentro del grupo
de afecciones testiculares, el varicocele fue el más frecuente entre los
pacientes de este estudio (23,2%). Las infecciones del tracto genitourinario se
observaron en el 11,6% de los pacientes. En general, las infecciones de los
testículos, epidídimos, próstata y vías urinarias están asociadas con
pioespermia y representan alrededor del 5% de las causas de infertilidad masculina
en la mayoría de los centros de reproducción mundiales32,33.
El
establecimiento de relación estadística entre las alteraciones espermáticas y
los FR analizados, fue una limitante del presente estudio por el escaso número
de historias clínicas con estos datos. Sin embargo, se observó que dentro de
los pacientes con varicocele, la alteración más frecuente fue la
astenozoospermia (57,7%) con relación estadísticamente significativa (p=0,004),
seguida por licuefacción parcial, hiperviscosidad y vitalidad disminuida. Por
su parte, en el grupo con registro de hábitos tóxicos lo más frecuente fue la
licuefacción parcial seguida de leucospermia e hiperviscosidad, finalmente en
pacientes con infecciones genitourinarias se registraron porcentajes elevados
de licuefacción parcial, hiperviscosidad y vitalidad disminuida.
Para
futuros estudios sería interesante aumentar la cantidad de pacientes analizados,
así como también la posibilidad de incorporar encuestas a fines de obtener
mayores datos respecto a posibles factores de riesgo de infertilidad, ambas
consideraciones impactarían positivamente en la robustez de los resultados del
estudio. Del mismo modo, sería de gran impacto en el
análisis pos-analítico del espermograma promover que el personal de salud
involucrado registre de manera exhaustiva la información pertinente al estudio
del semen.
La
importancia de este estudio radica en la caracterización regional tanto de los
parámetros mayormente alterados del espermograma como de FR asociados a
infertilidad masculina en pos de trabajar en forma interdisciplinaria para que los
pacientes puedan realizar el tratamiento de fertilidad pertinente, el
seguimiento de una patología o el análisis de su capacidad reproductiva.
AGRADECIMIENTOS
Al Laboratorio de Alta Complejidad de Misiones, especialmente al
sector de Endocrinología, y a las técnicas en Laboratorio Laura Kotik y Noelia Paiva.
Tabla 1. Alteraciones en los
parámetros macroscópicos y fisicoquímicos del espermograma (n=334)
|
Parámetros
alterados
|
n (%)
|
*IC 95%
|
|
Volumen
hipospermia
|
27 (8,1%)
|
5,5-11,7
|
|
Viscosidad
aumentada
|
143
(42,8%)
|
37,5-48,3
|
|
Licuefacción
parcial
|
177
(53,0%)
|
47,5-58,4
|
|
pH
alterado
|
5
(1,5 %)
|
0,6-3,
7
|
|
|
|
|
*Intervalo
de confianza.
Tabla
2. Factores de riesgo asociados a infertilidad (n=112)
|
Factores
de riesgo asociados a infertilidad
|
n
|
%
|
|
Afecciones
testiculares
|
Varicocele
Criptorquidia
Hidrocele
Cáncer
de testículo
|
26
4
2
1
|
23,2
3,6
1,8
0,9
|
|
Infecciones
del tracto genitourinario
|
ITU
Micosis
inguinal y peneana
|
11
2
|
9,8
1,8
|
|
Obstrucciones
anatómicas
|
Litiasis
ureteral
|
5
|
4,5
|
|
Hábitos
tóxicos
|
Tabaquismo
Alcohol
Drogas
ilegales
|
30
23
7
|
26,7
20,5
6,2
|
|
|
|
|
|
Tabla
3. Relación entre factores de riesgo de infertilidad y alteraciones
espermáticas.
|
FR* registrados
en 112 HC† (33,0%)
/
Alteraciones espermáticas
|
Hábitos tóxicos
(n=47; 42,0%):
-Tabaquismo (n=30; 26,7%)
-Alcohol (n=23; 20,5%)
-Drogas (n=7; 6,2%)
|
Varicocele
(n=26; 23,2%)
|
Infecciones genitourinarias
(n=13; 11,6%)
|
|
Hipospermia
|
2 (4,2%)
|
3 (11,5%)
|
1 (7,7%)
|
|
Hiperviscosidad
|
19 (40,4%)
|
10 (38,5%)
|
3 (23,1%)
|
|
Licuefacción
parcial
|
23 (48,9%)
|
15 (57,6%)
|
4 (30,8%)
|
|
Ph alterado
|
0
|
2 (7,7%)
|
2 (15,4%)
|
|
Astenozoospermia
|
13 (27,7%)
|
15 (57,7%) [Chi²=8,3; p=0.004] ‡
|
1 (7,7%)
|
|
Vitalidad
disminuida
|
4 (8,5%)
|
10 (38,5%)
|
3 (23,1%)
|
|
Oligospermia
|
9
(19,1%)
|
7
(26,9%)
|
0
|
|
Azoospermia
|
1
(2,1%)
|
0
|
1
(7,7%)
|
|
Teratozoospermia
|
9
(19,1%)
|
8
(30,8%)
|
0
|
|
Leucospermia
|
21 (44,7%)
|
9 (34,6%)
|
1 (7,7%)
|
*FR: factores de
riesgo; †HC: historias clínicas; ‡
p=Chi
cuadrado de Pearson.
Gráfico 1. Alteraciones
morfológicas de la cabeza.
Gráfico
2. Alteraciones morfológicas de la pieza intermedia.
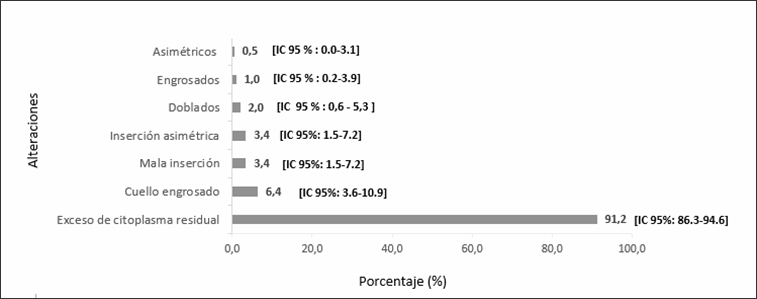
Gráfico 3. Alteraciones
morfológicas de cola.
REFERENCIAS BIBLIOGRÁFICAS
1Agudelo
H, Senovia M, Maya C. Evaluación de los parámetros seminales en 30 hombres con
fertilidad probada y breve revisión de la literatura. Revista Cubana de
Obstetricia y Ginecología 2013; 39 (4), 368-82. [Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2013000400006]
2López
M, Urbano A, Cárdenas M. Manual de laboratorio para el análisis del semen. Omniascience,
2012. https://doi.org/10.3926/oss.5
3Ariagno
J, Mormandi E. Guía práctica para la evaluación del semen. Revista
Bioquímica y Patología Clínica, 2016; 80 (3):29-36. https://doi.org/10.62073/bypc.v80i3.120
4Gutarra
Vara J, Quispe Castillejo L. Factores de riesgo de la infertilidad masculina en
el Hospital Nacional Edgardo Rebagliati Martins en 1996-2000 [Tesis grado, Univ
Nac Mayor San Marcos]. Repositorio de la Univ San Marcos, 2005. [Disponible
en: https://hdl.handle.net/20.500.12672/1814]
5Vásquez
R, Vásquez Echeverri D. Espermograma y su utilidad clínica. Salud Uninorte,
2007; 23(2): 220-30. [Disponible en: http://www.scielo.org.co/pdf/sun/v23n2/v23n2a09.pdf]
6Sarabia
L, Munuce M J. Nuevos valores para el espermograma OMS 2010. Revista Médica
de Chile, 2011; 139(4): 548-49. https://doi.org/10.4067/s0034-98872011000400020
7Organización
Mundial de la Salud. WHO laboratory manual for
the examination and processing of human semen 2010; (5°ed.) [Disponible
en: https://iris.who.int/handle/10665/44261]
8Organización
Mundial de la Salud. WHO laboratory manual for
the examination and processing of human semen 2021; (6° ed.) [Disponible
en: https://www.who.int/publications/i/item/9789240030787]
9Carvajal-Rivero
MA, Miranda-Bello C, Hernández- Rodríguez M, Díaz-González N, Gómez-Ferrer D.
Relación entre los factores de riesgo de infertilidad masculina y las
alteraciones del espermograma. Revista Electrónica Dr. Zoilo E. Marinello
Vidaurreta, 2021; 46(5): 1–7. [Disponible en: https://revzoilomarinello.sld.cu/index.php/zmv/article/view/2821]
10Paparella
C, Pavesi A, Provenzal O, Ombrella A, Bouvet B. Infertilidad masculina.
Exposición laboral a factores ambientales y su efecto sobre la calidad seminal.
Revista Uruguaya de Medicina Interna, 2017; 2 (2): 10-21. [Disponible
en: http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S2393-67972017000200010]
11Maleki
BH, Tartibian B. COVID-19 and male reproductive function: A prospective,
longitudinal cohort study. Reproduction, 2021;
161(3): 319-31. https://doi.org/10.1530/rep-20-0382
12Figueredo
Cabrera I. COVID-19 y fertilidad masculina. Revista Cubana de
Investigaciones Biomédicas, 2021; 40 (1). [Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03002021000200017]
13Molina
RI, Martini AC, Tissera A, Olmedo J, Senestrari D, Fiol de Cuneo M, Ruiz R. D.
Envejecimiento y calidad seminal: un análisis de 9168 casos en Córdoba, Argentina.
Archivos Españoles de Urología, 2010; 63 (3): 214-22. https://doi.org/10.4321/s0004-06142010000300007
14Cánepa
MA, Falco MB, Nievas M T, Palma G. Evaluación de parámetros seminales en
pacientes del servicio de laboratorio área fertilidad del Hospital Materno
provincial “Dr. Raúl Felipe Lucini” 2013-2015. Colegio Profesional de Ciencias
Bioquímicas de la Provincia de Córdoba, 2016. [Disponible en: https://www.cobico.com.ar/wp-content/archivos/2016/03/4-EVALUACION-DE-PARAMETROS-SEMINALES-MAT-PROV.pdf]
15Tournaye
H, Krausz C, Oates RD. Novel concepts in the aetiology of male reproductive
impairment. Lancet Diabetes Endocrinol,
2017; 5 (7): 544-53. https://doi.org/10.1016/s2213-8587(16)30040-7
16Vidal
C. Esterilidad e infertilidad humanas. Abordaje y tratamiento. Rev de
Farmacia Profesional, 2001;15(8): 96-101. [Disponible en: https://www.academia.edu/25102315/Esterilidad_e_infertilidad_humanas_Abordaje_y_tratamiento]
17Jarow
J, Sigman M, Kolettis P. The Optimal Evaluation of the Infertile Male: AUA Best
Practice Statement. American Urological Association Education and Research,
2010. [Disponible en: file:///D:/Usuario/Downloads/Male-Infertility-d.pdf]
18Aguirre
Canchumuni
M.
Infertilidad
masculina y espermograma anormal en pacientes atendidos en un centro de salud
privado de Huancayo, 2021- 2023. [Tesis 2025 Facultad
de Ciencias de la Salud Programa Académico de Tecnología Médica en Laboratorio
Clínico y Anatomía Patológica - Lima, Perú] [Disponible en: https://repositorio.uwiener.edu.pe/server/api/core/bitstreams/5fd0724a-f779-4db1-8d21-fee3723c7454/content]
19Juárez
Lazo M, Pérez Blandon E, Mayorga Perez O. Análisis del líquido seminal en
pacientes con edades comprendidas entre 19 y 35 años que asisten a consulta a
la Clínica Santa Lucía Estelí en el período comprendido entre Diciembre 2007 –
Marzo 2008. 2008:32-38 [Disponible en: http://riul.unanleon.edu.ni:8080/jspui/handle/123456789/1367]
20Palma
C, Vantman D. Infertilidad masculina: causas y diagnóstico. Revista Médica
Clínica Las Condes, 2021; 32(2): 180-8. https://doi.org/10.1016/j.rmclc.2021.01.004
21Fontanilla
D, Ramírez J, Dávila A, Rodríguez J, Arenas C, Lucena E. La edad sobre el
factor masculino y su efecto en la fertilidad de pareja. Revista
Colombiana de Obstetricia y Ginecología. 2009; 60 (2):159-164. https://doi.org/10.18597/rcog.341
22Morey-León
G. Caracterización de la calidad del semen en hombres atendidos en un centro de
reproducción asistida en Guayaquil, Ecuador. Revista Peruana de Medicina
Experimental y Salud Pública, 2020; 37 (2): 292-6. https://doi.org/10.17843/rpmesp.2020.372.4973
23Rodríguez
Pendás BV, Toledo Sánchez CA, Gómez Alzugaray M, Santana Pérez F, Domínguez
Alonso E. Alteraciones morfológicas de espermatozoides humanos por microscopía
electrónica de barrido. Revista Cubana de Endocrinología, 2013; 24(2):
153-160. [Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532013000200005]
24Rodríguez
Pendás BV, Santana Pérez F, Domínguez Alonso E, Nurquez Guerra B, Reyes
Rodríguez H. Leucocitos seminales y calidad espermática de hombres en estudio
de infertilidad. Revista Cubana de Endocrinología, 2016; 27(1). [Disponible
en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532016000100003]
25Barazani
Y, Katz BF, Nagler HM, Stember DS. Lifestyle, environment, and male
reproductive health. Urol Clin North Am, 2014; 41:55-66. https://doi.org/10.1016/j.ucl.2013.08.017
26
American Society for Reproductive
Medicine. Practice Committee of American Society for Reproductive Medicine:
Smoking and infertility. Fertil Steril, 2008; 90 (5): 254-9. https://doi.org/10.1016/j.fertnstert.2008.08.035
27Augood
C, Duckitt K, Templeton AA. Smoking and female infertility: A systematic review
and meta-analysis. Hum Reprod, 1998; 13:1532-39. https://doi.org/10.1093/humrep/13.6.1532
28Muthusami
KR, Chinnaswamy P. Effect of chronic alcoholism on male fertility hormones and
semen quality. Fertil Steril, 2005; 84:919-24.
https://doi.org/10.1016/j.fertnstert.2005.04.025
29Battista
N, Pasquariello N, Di Tommaso M, Maccarrone M. Interplay between
endocannabinoids, steroids and cytokines in the control of human reproduction. J
Neuroendocrinol, 2008; 20 (1):82-9. https://doi.org/10.1111/j.1365-2826.2008.01684.x
30Sadeu
JC, Hughes CL, Agarwal S, Foster WG. Alcohol, drugs, caffeine, tobacco, and
environmental contaminant exposure: reproductive health consequences and
clinical implications. Crit Rev Toxicol, 2010; 40 (7):633-52.
https://doi.org/10.3109/10408444.2010.493552
31George
VK, Li H, Teloken C, Grignon DJ, Lawrence WD, Dhabuwala CB. Effects of
long-term cocaine exposure on spermatogenesis and fertility in peripubertal
male rats. J Urol, 1996; 155:327-331. https://doi.org/10.1016/s0022-5347(01)66654-0
32Teppa-Garrán
AD, Palacios-Torres A. Evaluación actual de la infertilidad masculina. Investigación
Clínica, 2004; 45(4): 355-370. [Disponible en: https://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0535-51332004000400008]
33Janssen
NM, Genta MS. The effects of immunosuppressive and anti-inflammatory
medications on fertility, pregnancy, and lactation. Arch Intern Med,
2000; 160:609-10. https://doi.org/10.1001/archinte.160.5.610